Elektrolyse mit Elektrolyt
Die Elektrolyse von Wasser besteht aus zwei Teilreaktionen, die an den beiden Elektroden (Kathoden- und Anodenräumen) ablaufen. Das Gesamt-Reaktionsschema dieser Redoxreaktion lautet:
2 H2O (l) → 2 H2 (g) + O2 (g)
Vereinfacht dargestellt wird Wasser durch elektrischen Strom in Wasserstoff und Sauerstoff gespalten.
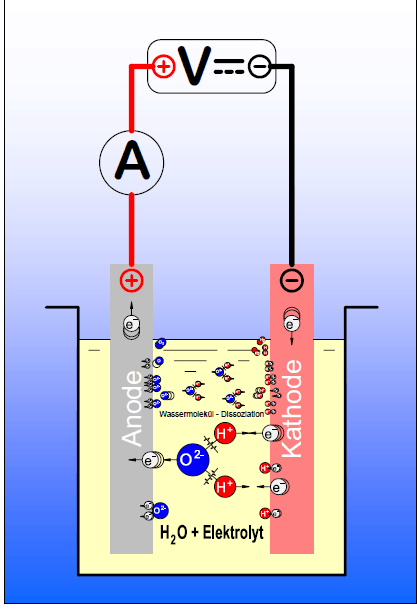
Die Elektroden tauchen in Wasser ein, welches durch die Zugabe von etwas Säure, bevorzugt Schwefelsäure, besser leitend gemacht wird (deswegen Wasser + Elektrolyt).
Positiv geladene Oxonium-Ionen (H3O+) wandern im elektrischen Feld zu der negativ geladenen Elektrode (Kathode), wo sie jeweils ein Elektron aufnehmen. Dabei entstehen Wasserstoff-Atome, die sich mit einem weiteren, durch Reduktion entstandenen H-Atom zu einem Wasserstoffmolekül vereinigen. Übrig bleiben Wassermoleküle.
Kathodenraum:
4 H3O+ + 4 e− → 2 H2 + 4 H2O
oder auch:
4 H2O + 4 e− → 2 H2 + 4 OH−
Der abgeschiedene, gasförmige Wasserstoff steigt an der Kathode auf, wobei der Kathodenraum basischer wird.
Die negativ geladenen Hydroxid-Anionen (OH–) wandern zur positiven Anode, wobei sich negative Hydroxidionen mit Protonen zu Wasser neutralisieren oder sich an der Anode unter Elektronenabgabe zu Sauerstoff umwandeln.
Anodenraum:
4 OH− → O2 + 2 H2O + 4 e−
oder auch:
6 H2O → O2 + 4 H3O+ + 4 e−
Auch hier steigt der abgeschiedene Sauerstoff als Gas an der Anode auf, gleichzeitig wird der Anodenraum saurer. Die entstandenen Protonen wandern in Richtung Kathode – analog zu den Vorgängen im Kathodenraum.
Die Gesamtreaktionsgleichung der Elektrolyse von Wasser lautet (Addition der Kathoden- und Anodenraum Gleichungen):
4 H3O+ + 4 OH− → 2 H2 + O2 + 6 H2O
Die auf der linken Seite stehenden Hydronium-Ionen (H3O+) – (neuer: „Oxonium-“) und Hydroxid-Ionen entstammen der Autoprotolyse des Wassers (In reinem Wasser ohne Säure- oder Basezugabe findet eine Autoprotolyse statt. Das heißt, dass in reinem Wasser schon H3O+-Kationen und OH– -Anionen existieren):
8 H2O → 4 H3O+ + 4 OH−
Man kann die Elektrolysegleichung daher auch folgendermaßen schreiben:
8 H2O → 2 H2 + O2 + 6 H2O
bzw. als eigentliche Reaktion:
H2O → 2 H2 + O2
Elektrolyse mit dem Membranverfahren
Die Elektrolyse von Wasser gelingt eigentlich nur unter Zusatz von Schwefelsäure oder Sulfaten. Erst einmal muss das Wasser leitend sein (damit die Ionen überhaupt wandern können). Außerdem sind die Sulfat-Ionen als Katalysatoren bei der Sauerstoffbildung beteiligt.
Mit Kationenaustauschermembranen gelingt die Elektrolyse aber schon mit Reinstwasser. Damit umgeht man Korrosionsprobleme und die Handhabung von aggressiver Schwefelsäure.
Man bezeichnet diese Membranen kurz mit PEM (engl. polymer electrolyte membrane). Die Reaktionsräume werden durch eine Kationenaustauscher-Membran getrennt, die nur für Protonen durchlässig ist. Die Membran spielt also die Rolle des Elektrolyten.
Legt man an eine Elektrolysezelle eine Gleichspannung an, die größer ist als die sogenannte Zersetzungsspannung des Wassers, dann fließt ein elektrischer Strom an den Elektroden. Der Anode werden Elektronen entzogen, in die Kathode dagegen hineingepumpt. Es baut sich ein Potential auf. Dadurch erhalten die durch die Autopyrolyse des Wassers gebildeten Protonen aus dem Anodenraum einen Zug in Richtung auf die Kathode. Sie wandern durch die Kationenaustauscher-Membran in den Kathodenraum, wo sie mit Wasser unter Bildung von Hydronium-Ionen reagieren (H+ + H2O → H3O+).
Die elektrolytische Ozonerzeugung
Um bei der Wasserelektrolyse an der Anode Ozon zu erzeugen ist ein Elektrokatalysator notwendig. Denn die Energie, und damit die chemische Reaktivität des bei der Sauerstoffentwicklung als Zwischenprodukt entstehenden adsorbierten Sauerstoffs, nehmen mit steigender Überspannung zu. Bei einem Elektroden-Potential oberhalb ca. 2,3 V ist theoretisch die Bildung von freien Sauerstoffatomen möglich. Die Reaktionen zur Ozonbildung sind dann folgende:
3 H2O → O (ads) + 2 H3O+(aq) + 2 e–
6 H2O → O2 (ads) + 4 H3O+ + 4 e–
O (ads) + O2 (ads) → O3 (g)
Freie Sauerstoffatome sind sehr reaktiv und können mit molekularem Sauerstoff (O2) reagieren und damit Ozon (O3) bilden.
Die elektrolytische Ozonerzeugung mit Polymer-Elektrolyt-Membran (PEM) Elektrolysezellen funktioniert wie nachstehend beschrieben.
An Stelle eines flüssigen Elektrolyten wird ein Feststoffelektrolyt verwendet. Dieser besteht aus einem Polymer, welcher die Eigenschaft eines Elektrolyten hat, elektrische Ladungen, hier sind es Wasserstoffionen / Protonen (Kationenaustauschermembran), zu transportieren. Gleichzeitig dient die Membran als Separator für die physikalische Trennung der Elektrolyseprodukte:
Anodenseitig entstehen dann Sauerstoff und Ozon. Kathodenseitig entsteht Wasserstoff.
Neben der Substitution der flüssigen Elektrolytlösung durch die PEM-Membran lag und liegt der Schwerpunkt der Entwicklungsarbeit bei den Elektroden, denn die Elektroden bestimmen maßgeblich die Effizienz, sprich den Wirkungsgrad/ Strom-ausbeute einer PEM-Elektrolysezelle.
Die Anode besteht aus einem porösen, wasserdurchlässigen und stromleitenden Trägermaterial (Titan) und einer aktiven Schicht (PbO2). An den Berührungsstellen dieser Schicht mit der Feststoff-Elektrolytmembran, die den Anoden- vom Kathodenraum physikalisch trennt, entsteht bei Anlegen von Gleichstrom hochkonzentriertes Ozon.
Das konstruktive Problem liegt dabei in der Form der Elektrode, die auf der einen Seite mit ihrer aktiven Oberfläche die Membran zu berühren hat, dazwischen jedoch Freiräume für die Durchströmung des Wassers haben muss.
Mit der elektrischen Stromversorgung kann die Ozonerzeugung stufenlos geregelt und überwacht werden.
PbO2 ist als Elektrode in flüssigen wässerigen Elektrolyten anodisch nicht langzeitstabil. Im Kontakt mit dem festen Membranelektrolyten ist die Korrosion von PbO2 jedoch sehr wirksam unterbunden. Das gilt aber nur, solange die Zelle auch mit Strom versorgt wird. Sonst läuft die Gegenreaktion ab und das PbO2 wird reduziert:
PbO2 + 2 e– + 4 H+ → Pb2+ + 2 H2O